药物开发
- 悬浮技术为药物开发提供创新解决方案

药物筛选是新药研发的核心环节,其目标是从海量候选药物中快速识别出具有治疗潜力的部分。而作为药物发现的重要方法,细胞培养技术与药物筛选密不可分,其用于了解体内细胞行为及其机制已有一个多世纪的历史 1。基于细胞的检测是药物筛选过程中收集定量生理相关信息的最全面方法之一,每年用于药物筛选的费用高达1350亿美元 2。细胞培养技术被广泛用于发现药物疗效、给药、药理作用和细胞毒性等,可涵盖如肿瘤药效评估、免疫治疗响应测试、毒性预测等关键场景 3。近年来,随着前沿技术的开发与应用,便利了药物筛选直至个性化诊疗的实施。例如3D细胞/类器官培养物在一定程度上再现了病灶组织特征,是患者来源组织的理想体外模型,为肿瘤的个性化治疗提供了可能 4, 5;而单细胞多组学分析则在在肿瘤研究中得到了广泛应用,包括肿瘤异质性研究、细胞发育轨迹研究,甚至预测生存和治疗反应等,为药物研发提供了新的方向 6, 7。
基于细胞的药物筛选模型尚需优化
作为体外模型,基于细胞的试验中使用的细胞需尽可能准确地代表要研究的系统,并表达相关因子和信号中间体。 但在现实中,却难尽人意。在细胞培养方面,尤其是3D培养中,因缺乏标准化方案(如不同细胞样本来源的异质性问题)而影响疾病建模的准确性和药物筛选结果的一致性 8,亟需高通量方案来优化涉及多个耗费大量人力和时间的实验流程 4,以及构建统一的鉴定标准结果的重复性与稳定性 9,从而限制了此技术的广泛应用;细胞多组学分析可帮助研究人员识别和详细说明疾病细胞状态的异质性,提高洞察分辨率 10,更精确地选择治疗的相关靶点,或分级疾病以推进精准医疗和个体化医疗的发展。这对细胞样本制备的要求极高,须保留样本中单个细胞的原生状态与细胞群的异质性。此外,联合单细胞蛋白组学(药物的终靶点多为蛋白质),则对单个细胞样本的完整性与位点未被覆盖有着额外高要求。
然而,传统细胞样本制备技术(如离心、流式分选术、免疫磁珠法等)均难以全部满足以上制备样本的要求,特别是在细胞完整性、原生状态及异质性保留方面。
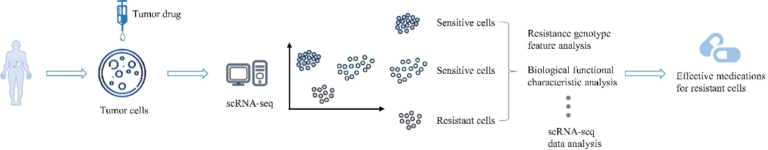
scRNA-seq 技术在肿瘤耐药性中的应用 6
悬浮技术的创新解决方案
悬浮技术 (Levitation Technology™) 为传统的细胞分离方法提供了一种创新、高效的替代方法,大大提升了细胞样本质量,从而给予了准确、可靠结果的保障。通过在磁场中引入顺磁性溶液,LeviCell®系统可使高活力细胞悬浮起来,有效地与死亡或垂死细胞分离开来,且无需任何染色或标记。这一简便流程包括3个简便的步骤,最快仅需5分钟即可完成,确保了高细胞活力与高得率,这对于精确的疾病特征测定至关重要。如来自加州大学旧金山分校(UCSF)的Diaz-Flores教授团队利用LeviCell® 1.0系统处理细胞样本以支持白血病药物的开发 11。
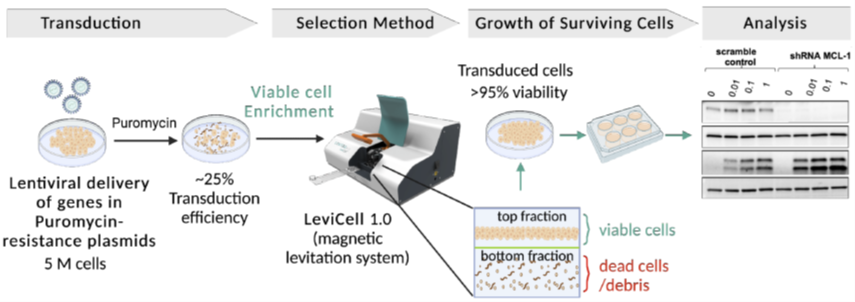
用磁悬浮系统富集转染慢病毒后的活细胞克隆 11
与可能导致兴趣细胞(尤其是稀有细胞群)丢失的传统方法不同,悬浮技术提供了一种革新性的细胞富集方法,温和的分离最大程度地减少了细胞压力并保留了细胞的完整性与原生状态,无需任何标记或染色可不偏不倚的富集所有细胞类型以保留细胞群的异质性。最新的LeviCell 96系统还可同时处理至多96个样本,从而满足药物开发中细胞处理的高通量需求。

- Harrison RG, Greenman MJ, Mall FP, Jackson CM (1907) Observations of the living developing nerve fiber. Anat Rec. 1907;1(5):116–
- DiMasi JA, Grabowski HG, Hansen RW. Innovation in the pharmaceutical industry: New estimates of R&D costs. J Health Econ. 2016 May;47:20-33.
- Cardoso BD, Castanheira EMS, Lanceros-Méndez S, Cardoso VF. Recent Advances on Cell Culture Platforms for In Vitro Drug Screening and Cell Therapies: From Conventional to Microfluidic Strategies. Adv Healthc Mater. 2023 Jul;12(18):e2202936.
- Wang Y, Jeon H. 3D cell cultures toward quantitative high-throughput drug screening. Trends Pharmacol Sci. 2022 Jul;43(7):569-581.
- Zuo J, Fang Y, Wang R, Liang S. High-throughput solutions in tumor organoids: from culture to drug screening. Stem Cells. 2025 Jan 17;43(1):sxae070.
- Zhang L, Yang Y, Tan J. Applications and emerging challenges of single-cell RNA sequencing technology in tumor drug discovery. Drug Discov Today. 2025 Feb;30(2):104290.
- Van den Berge K, Perraudeau F, Soneson C, et al. Observation weights unlock bulk RNA-seq tools for zero inflation and single-cell applications. Genome Biol. 2018 Feb 26;19(1):24.
- Kwak S, Song CL, Lee J, et al. Development of pluripotent stem cell-derived epidermal organoids that generate effective extracellular vesicles in skin regeneration. Biomaterials. 2024 Jun;307:122522.
- Tran T, Song CJ, Nguyen T, et al. A scalable organoid model of human autosomal dominant polycystic kidney disease for disease mechanism and drug discovery. Cell Stem Cell. 2022 Jul 7;29(7):1083-1101.e7.
- de Klerk E, ‘t Hoen PA. Alternative mRNA transcription, processing, and translation: insights from RNA sequencing. Trends Genet. 2015 Mar;31(3):128-39.
- Pariury H, Fandel J, Bachl S, et al. Venetoclax and dinaciclib elicit synergistic preclinical efficacy against hypodiploid acute lymphoblastic leukemia. Haematologica. 2023 May 1;108(5):1272-1283.