肿瘤分析
- 揭示癌症背后真正的生物学 推动个性化精准诊疗的发展
精准诊疗是近年肿瘤医学领域的重要突破方向,其核心在于通过整合个体基因、分子特征与临床数据,实现从诊断到治疗的全程个性化干预,以提升治疗效果并减少副作用。肿瘤精准诊疗的发展得益于多学科技术的发展与融合。随着以肿瘤细胞(如循环肿瘤细胞CTCs、脱落肿瘤细胞等)、循环肿瘤基因(如ctDNA、ctRNA等)、外泌体(Exosomes) 为主要检测对象的液体活检开始从技术探索逐步走向临床应用,为肿瘤的早期诊断和预后提供了新思路。例如,在肿瘤细胞方面:有研究者发现CTCs数量与肿瘤进展状态相关,可用于肿瘤诊断检测及转移风险评估1, 2, 3;也有研究显示,脱落细胞学检查在多种体液(如尿液、肺泡灌洗液等)中表现出良好的肿瘤早期诊断性能,尤其还可以联合肿瘤标志物检测、单细胞测序技术、人工智能(AI)等,以进一步提升检测的通量、敏感度与特异性 4, 5, 6, 7。

液体活检研究历程与里程碑事件 8
低质、复杂的样本固有特性阻碍着液体活检技术的应用
近年来,液体活检技术的开发与应用取得了显著进展,但其临床应用仍面临多种限制,待检样本的获取与制备就是其中关键一环,以肿瘤细胞样本为例:
- 细胞数量过少
据报道,CTCs在血液中的含量极低(每百万至千万个血细胞中可能才有1个或以上的CTCs),且存在时间也很短暂(单个CTCs为~25-30分钟,CTC clusters为~6-10分钟) 9, 10。其他体液中含有的脱落肿瘤细胞数量也同样相对稀少,让分离富集变得困难,使得下游检测结果多变 11。 - 低细胞活力
现有的分离技术在分离回收脱落肿瘤细胞时,为提高捕获效率,可导致其捕获过程对细胞产生损伤,破坏细胞完整性,进而影响后续的培养及分析(如单细胞测序 12等)应用。 - 细胞异质性
脱落肿瘤细胞具有高度异质性,不同细胞类型其表达的生物标志物种类及丰度存在显著差异。且在疾病发展的过程中,标志物表达丰度也可能下调,甚至缺失,从而导致基于单一标志物的分离方法无法有效捕获所有脱落肿瘤细胞 13。 - 分离富集技术的局限性
基于免疫选择的分离技术依赖于标志物(如EpCAM等),而难以捕获非上皮来源或低丰度表达标志物的脱落肿瘤细胞;基于物理特性的分离技术则依赖于脱落肿瘤细胞与血细胞在尺寸、密度或介电特性等方面的差异,通常无法精确区分开脱落肿瘤细胞与某些正常血细胞。14, 15 - 样本复杂性
脱落肿瘤细胞分离富集需要处理大量的样本,而样本中的杂质(如血小板、白细胞、细胞碎片团等)会对分离过程产生干扰,进一步增加了分离的难度。
利用悬浮技术克服肿瘤样本制备障碍
悬浮技术 (Levitation Technology™) 为各类肿瘤样本中细胞的分离富集提供了一种创新、高效的技术方法,可大幅提升基于细胞学检查的准确性与可靠性。通过在磁场中使用顺磁溶液,该系统能使三维结构完整的活细胞悬浮起来,从而有效地将它们与死亡或垂死细胞、细胞碎片及其他杂质分离开来。这个简便的过程包括三个简便的步骤,只需20分钟即可从低至数千个起始细胞中完成兴趣细胞的分离富集,确保了高细胞活力及高回收得率。优质的样本制备让下游精准的肿瘤检测事半功倍。
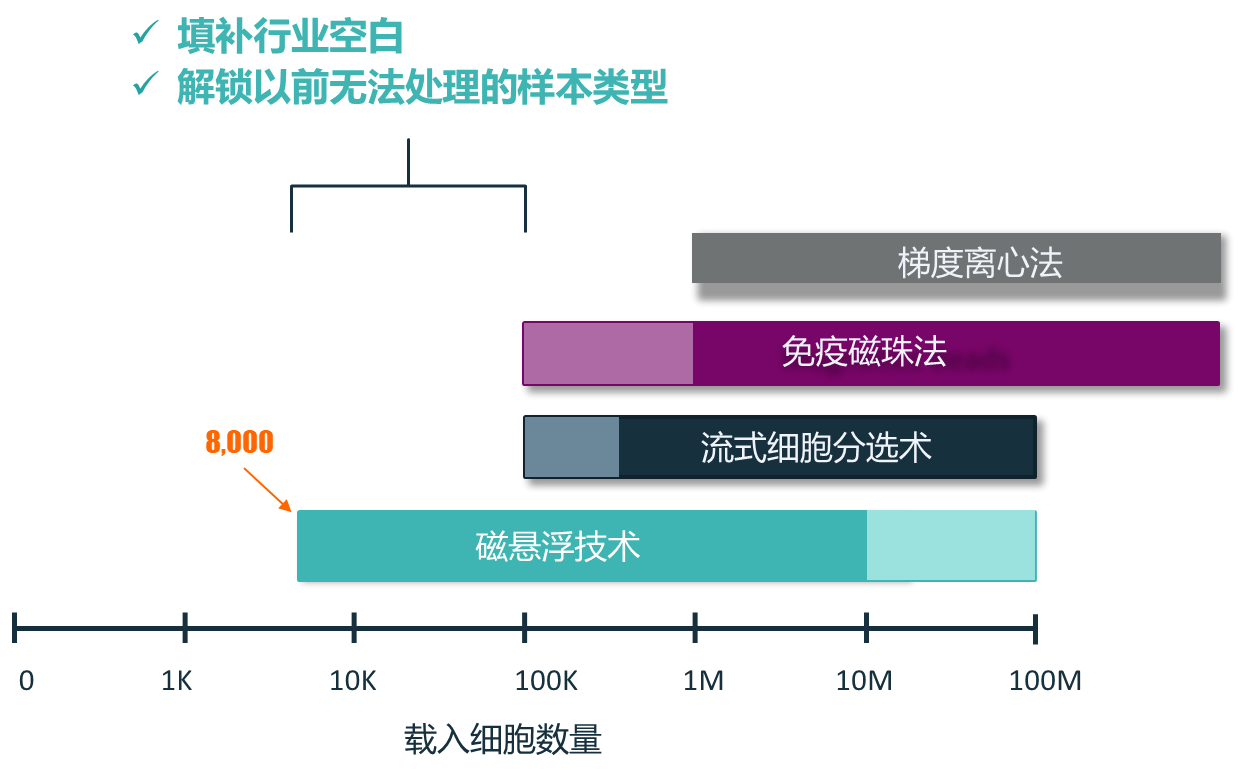
悬浮技术与其他技术方法可处理样本细胞数量的对比
高活力与高得率
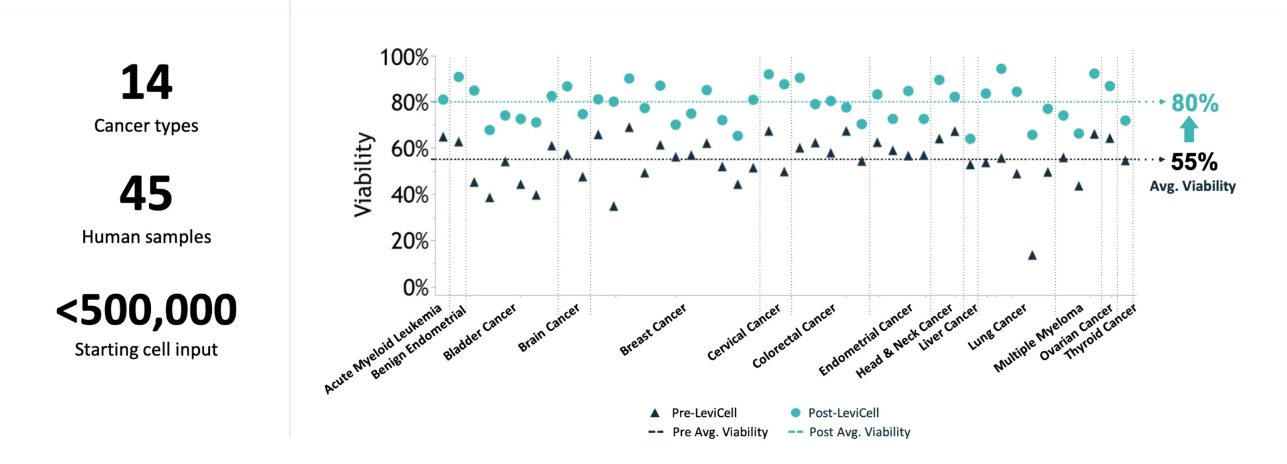
在一项利用悬浮技术处理各类人肿瘤极端低质样本的统计中,共涉及14个肿瘤类型,45例样本,单个样本的起始细胞总数量均在50万个以下。经LeviCell®系统处理后,结果显示细胞活力由55%提升到80%,可满足诸如单细胞测序等苛刻下游检测的要求。这为经细针穿刺活检(FNA)、支气管镜刷检等方式获得的肿瘤样本的处理,提供了完美解决方案。
体液样本处理
得益于悬浮技术可兼容的最低细胞起始数量特性,使其能游刃有余的面对各类肿瘤体液样本的处理,如尿液、脑脊液、胸腔积液、腹水等,为下游精准、可重复的检测应用提供优质样本。
利用LeviCell® 系统从脑脊液中分离富集纯净细胞及脱落肿瘤细胞
利用LeviCell® 系统从尿液中分离富集纯净细胞
CTCs分离富集
利用LeviCell®中内置的显微成像系统,可直接通过肉眼观测到CTCs或/和CTC Clusters从血样中悬浮于血细胞之上,且形态、直径明显更大,进而可被快速、轻柔的分离富集,供下游生化免疫、核酸等检测分析。

助力肿瘤个性化精准诊疗的落地(未来)
基于LeviCell®系统的可视化影像功能,在样本处理的同时,捕获悬浮细胞影像(明视野),并可利用单抗特异性识别肿瘤细胞(2个荧光通道)。随后,利用内置LeviMetricsTM软件的强大AI分析引擎,从细胞形态、细胞直径、悬浮高度(密度)、特异生物标志物等多个维度进行综合评分,并于数据库中已有细胞类型进行比对,进行肿瘤细胞的识别与鉴定,辅助肿瘤的早期筛查、诊断及预后评估。最后,被识别的肿瘤细胞还可被轻柔回收,供进一步分析(如基因耐药检测等)使用,从而整合、标准化从样本制备到脱落肿瘤细胞学检查(TCT、IHC等)、基因检测(qPCR、sc-Seq等)的完整流程,将样本周转时间(TAT)由数天缩短至数小时,为肿瘤个性化精准诊疗的落地实施提供了无限遐想空间。
- Lin D, Shen L, Luo M, et al. Circulating tumor cells: biology and clinical significance. Signal Transduct Target Ther. 2021 Nov 22;6(1):404.
- Cristofanilli M, Budd GT, Ellis MJ, et al. Circulating tumor cells, disease progression, and survival in metastatic breast cancer. N Engl J Med. 2004 Aug 19;351(8):781-91.
- Qiao GL, Qi WX, Jiang WH, et al. Prognostic significance of circulating tumor cells in esophageal carcinoma: a meta-analysis. Onco Targets Ther. 2016 Mar 31;9:1889-97.
- Xing J, Reynolds JP. Diagnostic Advances in Urine Cytology. Surg Pathol Clin. 2018 Sep;11(3):601-610.
- Zaidi A, Kaur H, Gupta P, et al. Role of bronchoalveolar lavage in diagnosing pulmonary infections and malignancies: Experience from a tertiary care center. Diagn Cytopathol. 2020 Dec;48(12):1290-1299.
- Kumar NB, Naylor B. Megakaryocytes in pleural and peritoneal fluids: prevalence, significance, morphology, and cytohistological correlation. J Clin Pathol. 1980 Dec;33(12):1153-9.
- Wang Z, Chen J, Yang L, et al. Single-Cell Sequencing-Enabled Hexokinase 2 Assay for Noninvasive Bladder Cancer Diagnosis and Screening by Detecting Rare Malignant Cells in Urine. Anal Chem. 2020 Dec 15;92(24):16284-16292.
- Pantel K, Alix-Panabières C. Circulating tumour cells in cancer patients: challenges and perspectives. Trends Mol Med. 2010 Sep;16(9):398-406.
- Gross HJ, Verwer B, Houck D, et al. Model study detecting breast cancer cells in peripheral blood mononuclear cells at frequencies as low as 10(-7). Proc Natl Acad Sci U S A. 1995 Jan 17;92(2):537-41.
- Ring A, Nguyen-Sträuli BD, Wicki A, Aceto N. Biology, vulnerabilities and clinical applications of circulating tumour cells. Nat Rev Cancer. 2023 Feb;23(2):95-111.
- Pairman L, Beckert LEL, Dagger M, Maze MJ. Evaluation of pleural fluid cytology for the diagnosis of malignant pleural effusion: a retrospective cohort study. Intern Med J. 2022 Jul;52(7):1154-1159.
- Wang Z, Zhao Y, Shen X, et al. Single-Cell Genomics-Based Molecular Algorithm for Early Cancer Detection. Anal Chem. 2022 Feb 8;94(5):2607-2614.
- Churg A, Naso JR. The Separation of Benign and Malignant Mesothelial Proliferations: New Markers and How to Use Them. Am J Surg Pathol. 2020 Nov;44(11):e100-e112.
- Rushton AJ, Nteliopoulos G, Shaw JA, Coombes RC. A Review of Circulating Tumour Cell Enrichment Technologies. Cancers (Basel). 2021 Feb 26;13(5):970.
- van der Toom EE, Verdone JE, Gorin MA, Pienta KJ. Technical challenges in the isolation and analysis of circulating tumor cells. Oncotarget. 2016 Sep 20;7(38):62754-62766.