细胞治疗
- LeviCell®助力探索细胞疗法研究的未来
人源肿瘤细胞疗法
细胞疗法是指将有活力的自体细胞或异体细胞移植到患者体内,以替代病变或受损细胞、调节细胞功能、或协助清除病变细胞或功能障碍细胞1。细胞疗法包括干细胞疗法(如间充质干细胞MSCs、诱导性多能干细胞iPSCs等)与非干细胞疗法(如嵌合抗原受体T细胞免疫疗法CAR-T、嵌合抗原受体自然杀伤细胞疗法CAR-NK等),为患者和医护人员带来了希望,因为它们有可能治疗曾被认为是不治之症的疾病2。尽管细胞疗法前景广阔,但研究人员和临床医生在研究、开发和生产阶段仍面临着种种障碍。且当前细胞疗法仍处于早期阶段,需要开展大量研究工作才能充分释放其潜力。为此,精确、准确和高效的细胞检测对于改善细胞疗法开发的研究和生产流程至关重要。
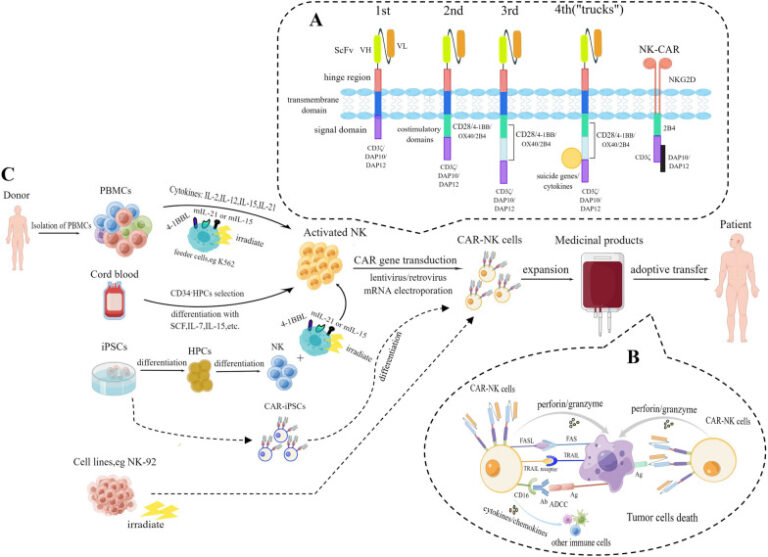
为癌症患者制备用于过继性转移免疫疗法的CAR-NK细胞3
细胞疗法开发中涉及到的常用细胞检测技术与方法
基于细胞的检测在细胞疗法开发中扮演着核心角色。鉴于细胞疗法产品的复杂性,评估细胞的各种特性对于准确预测其临床有效性与安全性至关重要。因此,美国食品及药物管理局要求细胞疗法测试过程中必须包括效力测定4。通常情况下,细胞效力测定需要同时进行几种互补测定,以全面了解细胞疗法的特性,克服单一检测方法的潜在局限性。
与细胞效力检测相关的一些最常见的细胞检测方法包括:
- 流式细胞术(Flow Cytometry) – 常用于量化病毒转导效率、蛋白质表达或其他与细胞表型及功能相关的特征3。
- 高通量成像(High-Throughput Imaging)- 基于成像的检测也可监测病毒转导,并描述细胞表型对治疗的反应5。
- 新陈代谢测定(Metabolism Assays)- 新陈代谢测定,如海马细胞能量代谢,可使研究人员通过测量对治疗和刺激反应的耗氧量,准确监测糖酵解和氧化代谢6。
- 测序(Sequencing) – 单细胞测序技术有助于对基因表达、相互作用、免疫和细胞异质性进行高分辨率分析7。
- 异种移植模型(Xenograft Models)- 患者来源的异种移植模型是通过将人类肿瘤样本植入免疫功能低下或人源化动物模型内来研究人类肿瘤细胞在体内的生长情况8。
- 杀伤试验(Killing Assays)- 杀伤或细胞毒性试验是测量免疫细胞介导的靶肿瘤细胞杀伤力和确定细胞疗法效力的敏感而特异性方法9。
- 生长测定(Growth Assays)- 生长测定对于评估细胞疗法的增殖和功能能力至关重要。常用的生长测定如MTT/MTS、CCK-8 和流式细胞术等10。
- 蛋白组学(Proteomics)- 蛋白组学分析是描述细胞疗法产品特性和诱导靶细胞群分子变化的重要而灵敏的工具11。
细胞检测中的常见挑战:“滚雪球效应”
尽管细胞疗法研究与工艺开发非常重要,但基于细胞的检测并非没有挑战。细胞检测结果的可靠性取决于起始细胞样本的质量。而低质起始细胞样本是细胞检测失败的主要原因之一,其特点是样本中活细胞不达标、含有死亡或垂死细胞以及细胞碎片。使用低质量的起始样本会破坏研究的可重复性及数据的有效性,并可能引发一连串的不良后果,影响检测和相关项目12:
细胞活力
提高细胞检测结果的最关键因素之一是通过温和的分离过程去除死亡或垂死细胞,从而提高待检样本的细胞活率,避免进一步影响活力13,14。
细胞碎片
细胞碎片及其他有毒刺激物的存在不仅会影响细胞活率测定结果,还会给下游检测带去高背景噪声,产生误导信号,甚至可能掩盖关键信息15,16。
温和的样本制备
采用温和的细胞分离富集方法,不影响细胞活力与完整性,不改变其基因表达,也不改变细胞群表征,这一点至关重要17,18。
效率
在选择最合适的样品制备方法以提高实成功率时,须将效率放在首位。
死细胞或垂死细胞的存在会导致细胞计数不准确,这意味着可能会对含有活细胞数量不足的样本进行检测;死细胞或垂死细胞以及相关的细胞碎片和分泌因子会影响检测的反应性,产生误导信号,破坏检测结果的完整性15, 19。由此还可能导致研究人员得出偏离客观事实的结论,并因怀疑药效问题而放弃开发一种有潜在价值的疗法;或可能会致使患者使用更大剂量的药物,从而在生产和不良反应方面产生问题。
此外,为了应对起始细胞样本质量低下的问题,就需要更多的生物学重复来抵消失败的尝试和不理想的结果。而每多增加一次重复实验,都会产生更多的费用、耗费更多的资源、需要更多的实验时间,从而导致测试通量降低和开发时间延长。即使在这些条件下完成了实验,结果也往往变化很大,数据分析变得更加复杂,进一步影响了项目的效率和周期20。
解决方案 悬浮技术提高结果
一直以来,常用的细胞分离富集技术包括离心、免疫磁珠(MACS)和荧光激活细胞分选(FACS)等方法21, 22, 23, 24。尽管这些方法很有用,但其都存在自身的局限性,从而难以面对前述的低质样本挑战。例如,MACS与FACS 方法都需要对细胞进行标记,这就在方案中引入了额外的耗时操作及细胞毒性风险,且它们往往无法高效清除样本中的碎片;而离心法虽不需要标记,也能去除碎片,但离心操作会对细胞造成较大压力,从而可对细胞活力产生不利影响25。
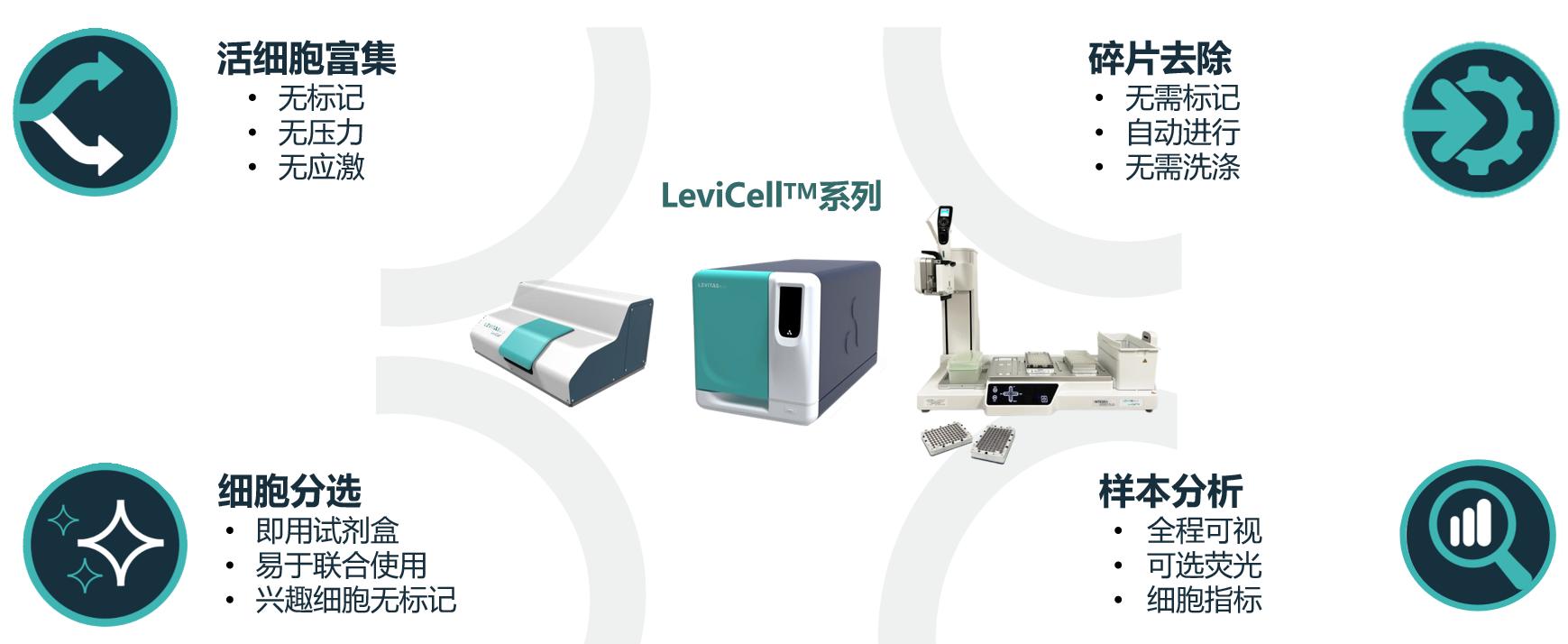
为了克服现有细胞分离富集方法的局限性,LevitasBio 开发出了基于悬浮技术(Levitation TechnologyTM)的LeviCell®系统,它利用磁场中的顺磁溶液将活细胞从死亡或垂死细胞、细胞碎片中分离富集出来,而无需任何标记或染色。这种方法不仅将细胞分离过程简化为3个简便步骤,在20分钟内即可完成,而且还能确保高细胞活率与回收得率,自动去除细胞碎片,这对准确可靠的细胞检测至关重要。与传统苛刻处理过程不同,悬浮技术提供了一种无标记、温和(<1 psi)的细胞富集方法,最大限度地减少了细胞压力并保留了细胞的原生状态,且不受起始细胞活力、数量及大小限制。这是一种创新、高效的细胞分离富集平台,可替代传统的细胞分离方法,显著提高细胞检测及相关数据的准确性和可靠性。此外,起始细胞样本质量的提高意味着每份样本都可以作为一个数据点使用,下游分析所需的过滤或数据校正也会减少。这将大大缩短开发耗时,提高数据的有效性,从而避免了资源和研究经费的浪费。

利用LeviCell®在肉眼可视化下从冻存的CAR-T细胞中富集活细胞(63%→96%),同时去除细胞碎片

利用LeviCell®在肉眼可视化下从iPSCs诱导的T细胞中富集活细胞(63%→93%),同时去除细胞碎片
- El-Kadiry AEH, Rafei M, Shammaa R. Cell Therapy: Types, Regulation, and Clinical Benefits. Front Med. 2021;8:756029.
- Marcuzzi A, Maximova N. Editorial: Advances in stem cell therapy: new applications and innovative therapeutic approaches. Front Med. 2023;10:1225551.
- Wang X, Yang X, Yuan X, et al. Chimeric antigen receptor-engineered NK cells: new weapons of cancer immunotherapy with great potential. Exp Hematol Oncol.
- Guidance for Industry: Potency Tests for Cellular and Gene Therapy Products, January 2011,https://www.fda.gov/media/79856/download. 2022;11(1):85.
- Sukumar UK, Habte F, Massoud TF, Paulmurugan R. High-Throughput Whole-Plate Imaging of Cells for Multiple Biological Applications. In: Kim SB, ed. Live Cell Imaging. Vol 2274. Methods in Molecular Biology. 2021:367-384.
- Joaquina S, Forcados C, Caulier B, Inderberg EM, Wälchli S. Determination of CAR T cell metabolism in an optimized protocol. Front Bioeng Biotechnol. 2023;11:1207576.
- Bode D, Cull AH, Rubio-Lara JA, Kent DG. Exploiting Single-Cell Tools in Gene and Cell Therapy. Front Immunol. 2021;12:702636.
- Liu Y, Wu W, Cai C, et al. Patient-derived xenograft models in cancer therapy: technologies and applications. Signal Transduct Target Ther. 2023;8(1):160.
- Kiesgen S, Messinger JC, Chintala NK, et al. Comparative analysis of assays to measure CAR T-cell-mediated cytotoxicity. Nat Protoc. 2021;16(3):1331-1342.
- Eekels JJM, Pasternak AO, Schut AM, et al. A competitive cell growth assay for the detection of subtle effects of gene transduction on cell proliferation. Gene Ther. 2012;19(11):1058-1064.
- Wang Y, Sun R, Ge W, et al. Longitudinal Serum Proteomics Characterization of CD19-CAR-T Cell Therapy for B-Cell Malignancies. J Proteome Res. 2023;22(9):2985-2994.
- Reddy OL, Stroncek DF, Panch SR. Improving CAR T cell therapy by optimizing critical quality attributes. Semin Hematol. 2020;57(2):33-38.
- Li A, Barabadi M, McDonald H, et al. Improving cell viability using counterflow centrifugal elutriation. 2022;24(6):650-658.
- Azqueta A, Stopper H, Zegura B, et al. Do cytotoxicity and cell death cause false positive results in the in vitro comet assay? Mutat Res Toxicol Environ Mutagen. 2022;881:503520.
- Ölander M, Handin N, Artursson P. Image-Based Quantification of Cell Debris as a Measure of Apoptosis. Anal Chem. 2019;91(9):5548-5552.
- Box A, DeLay M, Tighe S, et al. Evaluating the Effects of Cell Sorting on GeneExpression. J Biomol Tech JBT. 2020;31(3):100-111.
- Beliakova‐Bethell N, Massanella M, White C, et al. The effect of cell subset isolation method on gene expression in leukocytes. Cytometry A. 2014;85(1):94-104.
- Niepel M, Hafner M, Mills CE, et al. A Multi-center Study on the Reproducibility of Drug-Response Assays in Mammalian Cell Lines. Cell Syst. 2019;9(1):35-48.e5.
- Azqueta A, Stopper H, Zegura B, et al. Do cytotoxicity and cell death cause false positive results in the in vitro comet assay? Mutat Res Toxicol Environ Mutagen. 2022;881:503520.
- Caicedo JC, Cooper S, Heigwer F, et al. Data-analysis strategies for image-based cell profiling. Nat Methods. 2017;14(9):849-863.
- Liao X, Makris M, Luo XM. Fluorescence-activated Cell Sorting for Purification of Plasmacytoid Dendritic Cells from the Mouse Bone Marrow. J Vis Exp. 2016;(117):54641.
- Tomlinson MJ, Tomlinson S, Yang XB, Kirkham J. Cell separation: Terminology and practical considerations. J Tissue Eng. 2013;4:204173141247269.
- Plouffe BD, Murthy SK, Lewis LH. Fundamentals and application of magnetic particles in cell isolation and enrichment: a review. Rep Prog Phys. 2015;78(1):016601.
- Faridi MA, Ramachandraiah H, Iranmanesh I, et al. MicroBubble activated acoustic cell sorting. Biomed Microdevices. 2017;19(2):23.
- Kim IH, Yang JD, Lee DG, et al. Evaluation of Centrifugation Technique and Effect of Epinephrine on Fat Cell Viability in Autologous Fat Injection. Aesthet Surg J. 2009;29(1):35-39.